Озон хорошо реагирует далеко не со всеми органическими соединениями. Константы скоростей реакция озона с органикой могут отличаться на порядки. В тех случаях, когда окисление озоном ограничено, целесообразно его использовать в качестве источника более мощного окислителя – гидроксильных радикалов. Для этого используется реакции взаимодействия озона с перекисью водорода О3/Н2О2 (процесс PEROXONE).
| Соединения | Озон, М-1с-1 | ОН*, М-1с-1 |
| Ацетилен | 50 | 108 — 109 |
| Спирты | 10-2 – 1,0 | 108 — 109 |
| Альдегиды | 10 | 109 |
| Насыщенные УВ | 10-2 | 108 — 109 |
| Ароматические УВ | 1 — 102 | 108 — 1010 |
| Карбоновые кислоты | 10-3 – 10-2 | 107 — 109 |
| Непредельные хлор- углеводороды | 10-1 — 103 | 109 — 1011 |
| Кетоны | 1 | 108 — 1010 |
| Фенолы | 103 | 108 — 1010 |
В таблице для сравнения приведены константы скоростей взаимодействия различных органических соединений с озоном и ОН-радикалами.
Стехиометрическое соотношение озона и перекиси водорода в реакциях с образованием ОН-радикалов выглядит так: Н2О2 + 2O3 —> 2*OH + 3O2 (1)
Другим способом, получения ОН-радикалов с использованием озона является фотодиссоциация озона ультрафиолетовым излучением — О3/UV. Озон, растворенный в воде поглощает УФ-излучение в широком спектральном диапазоне, совпадающем с диапазоном излучения ламп TEOD-реакторов
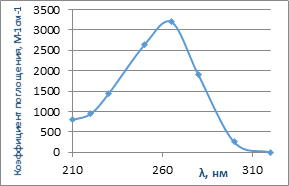
При облучении озона, растворенного в воде ультрафиолетом с длиной волны менее 300 нм наблюдается его распад на возбужденный атом кислорода О(1D) и синглетный кислород O2(1g). При этом образуется пероксид водорода Н2О2
О(1D) + H2O —> Н2О2, (2)
Прямой фотолиз озона происходит с выходом Ф=0,5. При этом выход в реакции:
О3 + Н2О + h√ —> 2*OH
не превышает 10%. Основной канал образования ОН-радикалов осуществляется при взаимодействии образовавшейся в реакции (2) перекиси водорода с ультрафиолетом с выходом Ф=1,0.
Преимуществом использования процессов TEOD/О3 состоит в том, что они не требуют реагентов и могут применяться как для водоочистки, так и очистке сточных вод.